人种/菌种差异可能影响药物的安全性、有效性、剂量和给药方案,使得新地区对国外临床试验数据的接受程度受到限制。中国目前临床大量使用的抗生素(包括进口的)均未在中国国内完成并没有发布药敏试验结果更没有获得中国药监局的批准。
全球耐药严峻,抗生素研发及合理应用愈发重要
所有药品都会有耐药性和耐受性问题。抗生素耐药性问题也是其中之一,抗耐药性感染正迅速成为常态,多重耐药细菌大量出现,严重威胁人类健康。G20杭州峰会中国政府承诺优先优惠支持中国企业开发新的抗耐药抗生素。根据美国2020年实施 IPPS 新抗生素使用方案,美国鼓励临床医生首先使用新的抗生素进行对症治疗,这样可以在有效时间窗内治疗,更有效保护生命,缩短治疗时间,节约治疗成本,有效防止耐药菌的产生。
药敏试验不再“一劳永逸”
药敏试验是抗生素药理学研究与应用的重要环节,可作为抗药性流行病学调查的基础数据,也可外推到体内杀菌效果,预测抗菌药物的临床治疗效果,在药物种类的选择上为临床医生提供帮助,以实施个体化治疗。是近年来中国抗生素临床研究提出的新要求的。对于已批准的进入中国的抗生素都要在事后补充这类研究,特别是要采用在中国区域的细菌菌种进行药敏研究。目前尚没有一家药企(包括美国辉瑞)在中国完成这项研究。
不同人种、不同菌种间药敏结果往往有较大差异。
药品在FDA、EMA注册,都要求提供人种差异的临床试验数据,至少需要做白人和黑人的,而且有最低多少比例的需求。人种差异是药品的临床响应,包括有效性和安全性,具有人种敏感性,其代谢动力学、药效学、安全性在不同人种间往往表现不同的特征,分为内因和外因。
就新型冠状病毒而言,就有五大变种家族。不同来源的新冠病毒毒株有不同的感染性,加上地理差异、菌种或病毒种类差异,一个治疗方案,往往不能全然奏效。
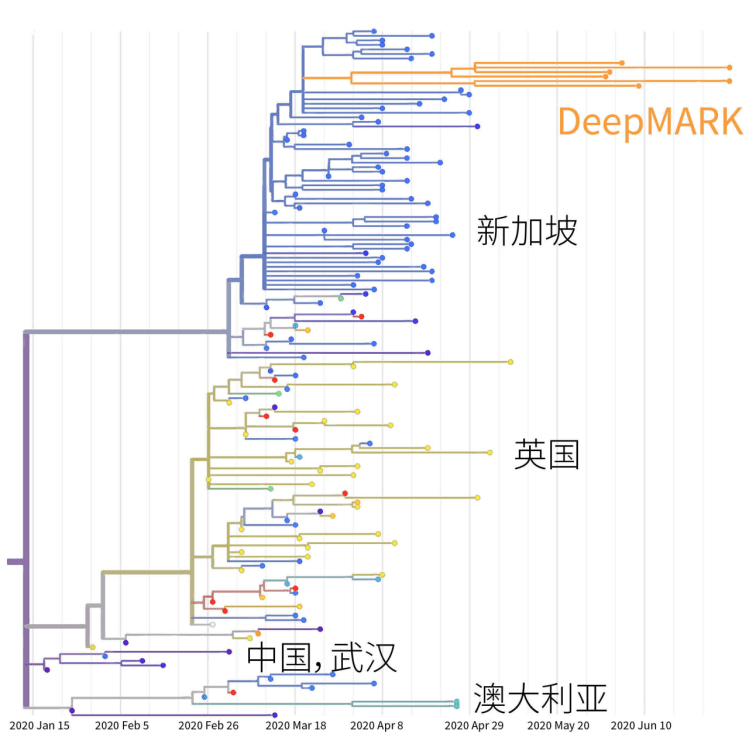
DeepMARK™ pipeline平台在一项关于不同来源乳酸菌的药敏试验研究中,10种常用抗生素药敏结果显示,在不同来源和菌种这两种因素中,来源区域不同是影响菌株药敏性的更主要因素。
所有抗生素均未在中国完成全部的药敏试验,特别是中国区域菌株的药敏试验
近几年来中国及欧美各国加快新药审批,激励抗耐药菌药物研发、上市。近十年来中国已上市包括复方抗生素在内的多种抗耐药抗生素,并逐渐规范抗生素合理应用,以应对临床耐药。
然而,目前在中国销售的抗生素均未在中国完成全部药敏试验。包括国内临床应对耐药感染常用的复方抗生素中,应用最广泛的头孢哌酮舒巴坦、哌拉西林他唑巴坦等药物,其单品在中国年销超50亿人民币,临床应用极为广泛,却至今仍未完成针对中国人群的药敏研究,未曾发布中国国内正式批准的药敏报告和中国药监局的批准。
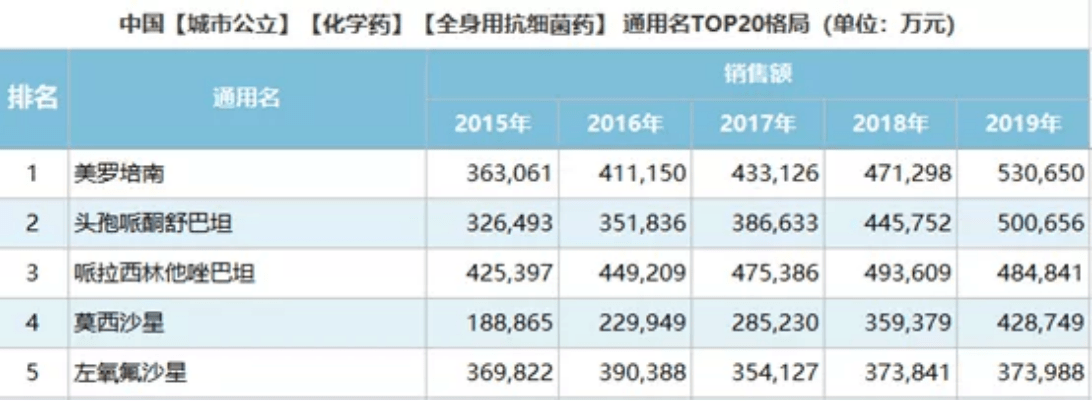
中国是一个具有14亿人口的国家,各种新药或中国市场上的非专利药品会更加广泛地运用于疾病的防治。积极在中国进行这些药品药代动力学研究、药效学与药物安全性资料的收集与分析,能为广大人民群众安全有效地使用各种新药提供重要的指导作用。
《生物安全法》包括细菌和病毒等都应积极应对微生物耐药和生物恐怖特别是垄断‼️
2020年10月17日,第十三届全国人民代表大会常务委员会第二十二次会议通过《中华人民共和国生物安全法》。其中生物安全,是指国家有效防范和应对危险生物因子及相关因素威胁(包括超级细菌等),生物技术能够稳定健康发展,人民生命健康和生态系统相对处于没有危险和不受威胁的状态,生物领域具备维护国家安全和持续发展的能力。
《生物安全法》要求积极应对微生物细菌耐药,保障人民生命健康相对不受威胁。应对微生物耐药,中国应鼓励新型抗生素研发,特别是对抗超级细菌抗耐药抗生素的研发和应用,加强药品质量管理,完善药物临床应用指导。同时,应防止临床药物被外企垄断,出现万一的情况,鼓励使用价格更合理的国产药替代美国在中国的药品,如国内的Ⅰ类(含1.1到1.6类)创新药和首仿药,更应该得到支持,进入中国医保目录,以保障中国医药医疗供应链安全,保障人民的健康安全和国家安全。
参考资料:
[1] Evslyn B, Toigo T, Bauls D, et al. Participation of racial/ethnic groups in clinical trials and race-related labeling. A review of new molecular entities approval. 1995-1999. J Nal Med Assoc , 2001, 93 (12) : Supplement.
[2]国际人用药品注册技术要求协会,ICH-E5(R1)- 国外临床数据可接受性的种族因素-19980205.
[3]李倩.世界各人种(族)参与临床试验的重要性[J].药物流行病学杂志,2002,11(3):122.
[4]曾小群,潘道东,郭宇星,等.不同来源乳酸菌的药敏试验[J].中国食品学报,2012,9:179-185.
[5]《中华人民共和国生物安全法》 责任编辑:guanliyuan
|

